U naše vrijeme fizika je postala vrlo uobičajena znanost. Doslovno je prisutan posvuda. Najelementarniji primjer: u vašem dvorištu raste stablo jabuke i na njemu sazrijevaju plodovi, dođe vrijeme i jabuke počnu padati, ali u kojem smjeru padaju? Zahvaljujući zakonu univerzalne gravitacije, naš fetus pada na tlo, odnosno ide dolje, ali ne i gore. Bio je to jedan od najpoznatijih primjera fizike, ali obratimo pažnju na termodinamiku, točnije, na fazne ravnoteže, koje nisu ništa manje važne u našem životu.
Termodinamika

Prije svega, pogledajmo ovaj pojam. ΘερΜοδυναΜική - ovako riječ izgleda na grčkom. Prvi dio ΘερΜo znači "toplina", a drugi dio δυναΜική znači "snaga". Termodinamika je grana fizike koja proučava svojstva makroskopskog sustava, kao i različite načine pretvaranja i prijenosa energije. U ovom dijelu posebno se proučavaju različita stanja i procesi kako bi se u opis mogao uvesti pojam temperature (to je fizikalna veličina koja karakterizira termodinamički sustav i mjeri se pomoćuodređeni uređaji). Svi tekući procesi u termodinamičkim sustavima opisani su samo mikroskopskim veličinama (tlak i temperatura, kao i koncentracija komponenti).
Clapeyron-Clausiusova jednadžba
Svaki fizičar zna ovu jednadžbu, ali hajde da je rastavite dio po dio. Odnosi se na ravnotežne procese prijelaza određene tvari iz jedne faze u drugu. To se jasno vidi na takvim primjerima: taljenje, isparavanje, sublimacija (jedan od načina očuvanja proizvoda, koji se odvija potpunim uklanjanjem vlage). Formula jasno pokazuje tekuće procese:
- n=PV/RT;
- gdje je T temperatura tvari;
- P-pritisak;
- R-specifična toplina faznog prijelaza;
- V-promjena određenog volumena.
Povijest stvaranja jednadžbe

Clausius-Clapeyronova jednadžba izvrsno je matematičko objašnjenje drugog zakona termodinamike. Također se naziva "Clausiusova nejednakost". Naravno, teorem je razvio sam znanstvenik, koji je želio objasniti odnos između toka topline u sustavu i entropije, kao i njegovog okruženja. Ovu jednadžbu razvio je Clausius u svojim pokušajima da objasni i kvantificira entropiju. U doslovnom smislu, teorem nam daje priliku da odredimo je li ciklički proces reverzibilan ili nepovratan. Ova nejednakost nudi nam kvantitativnu formulu za razumijevanje drugog zakona.
Znanstvenik je bio jedan od prvih koji je radio na ideji entropije, pa ju je čak i daonaziv procesa. Ono što je danas poznato kao Clausiusov teorem prvi je put objavljeno 1862. u Rudolfovom šestom djelu, O upotrebi teorema o ekvivalentnosti transformacije za unutarnje radove. Znanstvenik je pokušao pokazati proporcionalni odnos između entropije i protoka energije zagrijavanjem (δ Q) u sustavu. U građevinarstvu se ta toplinska energija može pretvoriti u rad, a može se cikličkim procesom pretvoriti u toplinu. Rudolph je dokazao da "algebarski zbroj svih transformacija koje se događaju u cikličkom procesu može biti samo manji od nule ili, u ekstremnim slučajevima, jednak nuli."
Zatvoreni izolirani sustav
Izolirani sustav je jedan od sljedećih:
- Fizički sustav je daleko od drugih koji s njima ne stupaju u interakciju.
- Termodinamički sustav zatvoren je čvrstim nepokretnim zidovima kroz koje ne mogu proći ni materija ni energija.
Unatoč činjenici da je subjekt interno povezan s vlastitom gravitacijom, izolirani sustav se obično uzima izvan granica vanjskih gravitacijskih i drugih udaljenih sila.
Ovo se može suprotstaviti onome što se (u općenitijoj terminologiji korištenoj u termodinamici) naziva zatvorenim sustavom okruženim selektivnim zidovima kroz koje se energija može prenositi u obliku topline ili rada, ali ne i materije. I s otvorenim sustavom u kojem materija i energija ulaze ili izlaze, iako može imati razne neprobojne zidovedijelovi svojih granica.
Izolirani sustav poštuje zakon očuvanja. Najčešće se u termodinamici materija i energija smatraju zasebnim pojmovima.
Termodinamički prijelazi
Za razumijevanje kvantnih faznih prijelaza, korisno je usporediti ih s klasičnim transformacijama (koji se također nazivaju toplinskim inverzijama). CPT opisuje vrhunac termodinamičkih svojstava sustava. Signalizira reorganizaciju čestica. Tipičan primjer je prijelaz smrzavanja vode, koji opisuje glatki prijelaz između tekućine i krutine. Klasični fazni rast nastaje zbog natjecanja između energije sustava i entropije njegovih toplinskih fluktuacija.
Klasični sustav nema entropiju na nultoj temperaturi i stoga ne može doći do fazne transformacije. Njihov je redoslijed određen prvim diskontinuiranim derivacijskim termodinamičkim potencijalom. I, naravno, ima prvi red. Fazne transformacije iz feromagneta u paramagnet su kontinuirane i drugog reda. Ove konstantne promjene iz uređene u neuređenu fazu opisuju se parametrom reda koji je nula. Za gornju feromagnetsku transformaciju, parametar reda bit će ukupna magnetizacija sustava.
Gibbsov potencijal
Gibbsova slobodna energija je maksimalna količina rada bez ekspanzije koja se može ukloniti iz termodinamičkog zatvorenog sustava (koji može izmjenjivati toplinu i raditi s okolinom). Takavmaksimalni rezultat može se dobiti samo u potpuno reverzibilnom procesu. Kada se sustav ponovno transformira iz prvog stanja u drugo, smanjenje Gibbsove slobodne energije jednako je onoj koju izvodi sustav u svom okruženju, minus rad sila pritiska.
Stanja ravnoteže

Termodinamička i mehanička ravnoteža je aksiomatski koncept termodinamike. To je unutarnje stanje jednog ili više sustava koji su povezani manje ili više propusnim ili nepropusnim zidovima. U ovom stanju nema čistih makroskopskih tokova materije ili energije, bilo unutar sustava ili između sustava.
U vlastitoj koncepciji stanja unutarnje ravnoteže, makroskopska promjena se ne događa. Sustavi su istovremeno u međusobnoj toplinskoj, mehaničkoj, kemijskoj (konstantnoj), radijacijskoj ravnoteži. Mogu biti u istom obliku. U ovom procesu svi se pogledi spremaju odjednom i na neodređeno vrijeme dok se fizička operacija ne prekine. U makroskopskoj ravnoteži odvijaju se savršeno precizne uravnotežene razmjene. Gornji dokaz je fizičko objašnjenje ovog koncepta.
Osnove
Svaki zakoni, teoremi, formule imaju svoje temelje. Pogledajmo 3 temelja zakona fazne ravnoteže.
- Faza je oblik materije, homogenog kemijskog sastava, fizičkog stanja i mehaničke ravnoteže. Tipične faze su čvrste, tekuće i plinovite. Dvije tekućine koje se ne miješaju (ili mješavine tekućina s različitim sastavima) odvojene zasebnom granicom smatraju se dvije različite faze i čvrste tvari koje se ne miješaju.
- Broj komponenti (C) je broj kemijski neovisnih komponenti sustava. Minimalni broj neovisnih vrsta potreban za određivanje sastava svih faza sustava.
- Broj stupnjeva slobode (F) u ovom kontekstu je broj intenzivnih varijabli koje su neovisne jedna o drugoj.
Klasifikacija po faznim ravnotežama
- Reakcije kontinuiranog neto prijenosa (često se nazivaju reakcijama u čvrstom stanju) javljaju se između čvrste tvari različitog sastava. Oni mogu uključivati elemente koji se nalaze u tekućinama (H, C), ali ti elementi se zadržavaju u čvrstim fazama, tako da tekuće faze nisu uključene kao reaktanti ili produkti (H2O, CO2). Čvrste čiste reakcije prijenosa mogu biti kontinuirane ili diskontinuirane, ili terminalne.
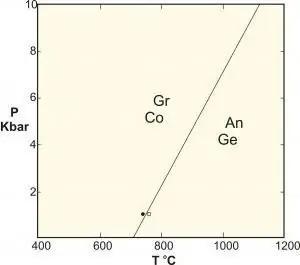
- Polimorfni su posebna vrsta reakcije čvrste faze koja uključuje faze identičnog sastava. Klasični primjeri su reakcije između aluminijskih silikata kijanit-silimanit-andaluzit, pretvorba grafita u dijamant pod visokim tlakom i ravnoteža kalcijevog karbonata.
Zakoni ravnoteže

Gibbsovo tvorničko pravilo predložio je Josiah Willard Gibbs u svom poznatom radu pod nazivom "Ravnoteža heterogenih supstanci", koji se pojavio od 1875. do 1878. godine. Odnosi se nanereaktivni višekomponentni heterogeni sustavi u termodinamičkoj ravnoteži i zadana je jednakost:
- F=C-P+2;
- gdje je F broj stupnjeva slobode;
- C - broj komponenti;
- P - broj faza u termodinamičkoj ravnoteži jedna s drugom.
Broj stupnjeva slobode je broj nezauzetih intenzivnih varijabli. Najveći broj termodinamičkih parametara, kao što su temperatura ili tlak, koji se mogu mijenjati istovremeno i proizvoljno bez utjecaja jedni na druge. Primjer jednokomponentnog sustava je onaj s jednom čistom kemikalijom, dok dvokomponentni sustavi, poput mješavine vode i etanola, imaju dvije neovisne komponente. Tipični fazni prijelazi (fazna ravnoteža) su čvrste tvari, tekućine, plinovi.
Pravilo faze pri konstantnom pritisku
Za primjene u znanosti o materijalima koje se bave faznim promjenama između različitih čvrstih struktura, često se javlja konstantan tlak (npr. jedna atmosfera) i zanemaruje se kao stupanj slobode, pa pravilo postaje: F=C - P + 1.
Ova se formula ponekad uvodi pod nazivom "pravilo kondenzirane faze", ali kao što znamo, nije primjenjiva na ove sustave koji su podložni visokim pritiscima (na primjer, u geologiji), budući da su posljedice ovih pritisci mogu uzrokovati katastrofalne posljedice.
Može se činiti da je fazna ravnoteža samo prazna fraza, a malo je fizičkih procesa u kojima ovaj trenutakje uključen, ali, kao što smo vidjeli, bez njega mnogi od poznatih zakona ne funkcioniraju, pa se morate malo upoznati s ovim jedinstvenim, šarolikim, iako pomalo dosadnim pravilima. Ovo znanje je pomoglo mnogim ljudima. Naučili su ih primijeniti na sebe, na primjer, električari, poznavajući pravila za rad s fazama, mogu se zaštititi od nepotrebne opasnosti.






