Svijet u kojem živimo nezamislivo je lijep i pun mnogo različitih procesa koji određuju tijek života. Sve te procese proučava poznata znanost - fizika. Pruža priliku da dobijete barem neku ideju o nastanku svemira. U ovom ćemo članku razmotriti takav koncept kao što je molekularna kinetička teorija, njezine jednadžbe, vrste i formule. Međutim, prije nego što prijeđete na dublje proučavanje ovih pitanja, morate sami sebi razjasniti samo značenje fizike i područja koja proučava.
Što je fizika?

Zapravo, ovo je vrlo opsežna znanost i, možda, jedna od najosnovnijih u povijesti čovječanstva. Na primjer, ako je ista informatika povezana s gotovo svim područjima ljudske aktivnosti, bilo da se radi o računskom dizajnu ili stvaranju crtića, onda je fizika sam život, opis njegovih složenih procesa i tokova. Pokušajmo razabrati njegovo značenje, pojednostavljujući razumijevanje što je više moguće.
DakleDakle, fizika je znanost koja se bavi proučavanjem energije i materije, veza između njih, objašnjenjem mnogih procesa koji se događaju u našem ogromnom svemiru. Molekularno-kinetička teorija strukture materije samo je mala kap u moru teorija i grana fizike.
Energija, koju ova znanost detaljno proučava, može biti predstavljena u raznim oblicima. Na primjer, u obliku svjetlosti, kretanja, gravitacije, zračenja, elektriciteta i mnogih drugih oblika. U ovom ćemo članku dotaknuti molekularnu kinetičku teoriju strukture ovih oblika.
Proučavanje materije daje nam ideju o atomskoj strukturi materije. Usput, to proizlazi iz molekularno-kinetičke teorije. Znanost o strukturi materije omogućuje nam da razumijemo i pronađemo smisao našeg postojanja, razloge nastanka života i samog Svemira. Pokušajmo ipak proučiti molekularnu kinetičku teoriju materije.
Prvo, potreban je uvod za potpuno razumijevanje terminologije i svih zaključaka.
Teme iz fizike
Odgovarajući na pitanje što je molekularno-kinetička teorija, ne može se ne govoriti o dijelovima fizike. Svaki od njih bavi se detaljnim proučavanjem i objašnjenjem određenog područja ljudskog života. Klasificirani su na sljedeći način:
- Mehanika, koja je podijeljena u još dva dijela: kinematika i dinamika.
- Statično.
- Termodinamika.
- Molekularni odjeljak.
- Elektrodinamika.
- Optics.
- Fizika kvanta i atomske jezgre.
Razgovarajmo konkretno o molekularnomfizike, jer se temelji na molekularno-kinetičkoj teoriji.
Što je termodinamika?
Općenito, molekularni dio i termodinamika su usko povezane grane fizike, koje proučavaju isključivo makroskopsku komponentu ukupnog broja fizikalnih sustava. Vrijedno je zapamtiti da ove znanosti opisuju upravo unutarnje stanje tijela i tvari. Na primjer, njihovo stanje tijekom zagrijavanja, kristalizacije, isparavanja i kondenzacije, na atomskoj razini. Drugim riječima, molekularna fizika je znanost o sustavima koji se sastoje od ogromnog broja čestica: atoma i molekula.
Upravo su te znanosti proučavale glavne odredbe molekularne kinetičke teorije.
Još u sedmom razredu upoznali smo se s pojmovima mikro- i makro-svjetova, sustava. Neće biti suvišno osvježiti ove pojmove u sjećanju.
Mikrosvijet, kao što možemo vidjeti iz samog imena, sastoji se od elementarnih čestica. Drugim riječima, ovo je svijet malih čestica. Njihove se veličine mjere u rasponu od 10-18 m do 10-4 m, a vrijeme njihovog stvarnog stanja može doseći i beskonačnost i nerazmjerno mali intervali, na primjer, 10-20 s.
Makrosvijet razmatra tijela i sustave stabilnih oblika, koji se sastoje od mnogih elementarnih čestica. Takvi su sustavi proporcionalni našoj ljudskoj veličini.
Osim toga, postoji nešto poput mega svijeta. Sastoji se od ogromnih planeta, kozmičkih galaksija i kompleksa.
Osnoveteorija
Sada kada smo malo rezimirali i prisjetili se osnovnih pojmova fizike, možemo prijeći izravno na glavnu temu ovog članka.
Molekularno-kinetička teorija pojavila se i formulirana po prvi put u devetnaestom stoljeću. Njegova bit leži u činjenici da detaljno opisuje strukturu bilo koje tvari (češće strukturu plinova nego čvrstih i tekućih tijela), na temelju tri temeljne odredbe koje su prikupljene iz pretpostavki tako istaknutih znanstvenika kao što su Robert Hooke, Isaac Newton, Daniel Bernoulli, Mikhail Lomonosov i mnogi drugi.
Glavne odredbe molekularne kinetičke teorije zvuče ovako:
- Apsolutno sve tvari (bez obzira na to jesu li tekuće, čvrste ili plinovite) imaju složenu strukturu, koja se sastoji od manjih čestica: molekula i atoma. Atomi se ponekad nazivaju "elementarne molekule".
- Sve ove elementarne čestice su uvijek u stanju kontinuiranog i kaotičnog kretanja. Svatko od nas je naišao na izravan dokaz ove tvrdnje, ali mu, najvjerojatnije, nije pridavao veliku važnost. Na primjer, svi smo vidjeli na pozadini sunčevih zraka da se čestice prašine neprestano kreću u kaotičnom smjeru. To je zbog činjenice da atomi međusobno proizvode međusobno potiskivanje, neprestano dajući jedni drugima kinetičku energiju. Ovaj je fenomen prvi put proučavan 1827. godine, a ime je dobio po otkriču - "Brownovsko gibanje".
- Sve elementarne čestice su u procesu kontinuirane interakcije jedna s drugomodređene sile koje imaju električnu stijenu.
Vrijedi napomenuti da je još jedan primjer koji opisuje položaj broj dva, a koji se također može primijeniti, na primjer, na molekularnu kinetičku teoriju plinova, difuzija. S njim se susrećemo u svakodnevnom životu, te u višestrukim testovima i kontrolama, pa je važno imati ideju o tome.
Prvo, razmotrite sljedeće primjere:
Doktor je slučajno prolio alkohol iz tikvice na stol. Ili vam je možda ispustila bočica parfema i ona se raširila po podu.
Zašto će u ova dva slučaja i miris alkohola i miris parfema nakon nekog vremena ispuniti cijelu prostoriju, a ne samo područje gdje je sadržaj tih tvari proliven?
Odgovor je jednostavan: difuzija.
Difuzija - što je to? Kako teče?

Ovo je proces u kojem čestice koje čine jednu određenu tvar (obično plin) prodiru u međumolekularne šupljine druge. U našim gornjim primjerima dogodilo se sljedeće: zbog toplinskog, odnosno kontinuiranog i disociranog kretanja, molekule alkohola i/ili parfema su pale u praznine između molekula zraka. Postupno, pod utjecajem sudara s atomima i molekulama zraka, šire se po prostoriji. Inače, intenzitet difuzije, odnosno brzina njezina strujanja, ovisi o gustoći tvari koje sudjeluju u difuziji, kao i o energiji gibanja njihovih atoma i molekula, koja se naziva kinetička. Što je kinetička energija veća, to je veća brzina ovih molekula, odnosno, i intenzitet.
Najbrži proces difuzije može se nazvati difuzijom u plinovima. To je zbog činjenice da plin nije homogen po svom sastavu, što znači da međumolekularne šupljine u plinovima zauzimaju značajnu količinu prostora, a proces ulaska atoma i molekula strane tvari u njih teče lakše i brže.
Ovaj proces je malo sporiji u tekućinama. Otapanje kockica šećera u šalici čaja samo je primjer difuzije krute tvari u tekućini.
Ali najduže vrijeme je difuzija u tijelima s čvrstom kristalnom strukturom. To je upravo tako, jer je struktura krutih tvari homogena i ima jaku kristalnu rešetku, u čijim stanicama titraju atomi krutine. Na primjer, ako se površine dviju metalnih šipki dobro očiste i zatim dovedu u dodir jedna s drugom, tada ćemo nakon dovoljno dugo vremena moći otkriti komadiće jednog metala u drugom, i obrnuto.
Kao i svaki drugi temeljni dio, osnovna teorija fizike podijeljena je na zasebne dijelove: klasifikaciju, vrste, formule, jednadžbe itd. Tako smo naučili osnove molekularne kinetičke teorije. To znači da možete sigurno nastaviti s razmatranjem pojedinačnih teorijskih blokova.
Molekularno-kinetička teorija plinova
Potrebno je razumjeti odredbe teorije plina. Kao što smo ranije rekli, razmotrit ćemo makroskopske karakteristike plinova, kao što su tlak i temperatura. Ovo jebit će potrebno kasnije kako bi se izvela jednadžba molekularno-kinetičke teorije plinova. Ali matematika - kasnije, a sada pozabavimo se teorijom i, sukladno tome, fizikom.
Znanstvenici su formulirali pet odredbi molekularne teorije plinova, koje služe za razumijevanje kinetičkog modela plinova. Zvuče ovako:
- Svi plinovi se sastoje od elementarnih čestica koje nemaju određenu veličinu, ali imaju određenu masu. Drugim riječima, volumen ovih čestica je minimalan u usporedbi s duljinom između njih.
- Atomi i molekule plinova praktički nemaju potencijalnu energiju, odnosno, prema zakonu, sva energija je jednaka kinetičkoj.
- Već smo se ranije upoznali s ovim položajem - Brownovsko gibanje. To jest, čestice plina su uvijek u kontinuiranom i kaotičnom kretanju.
- Apsolutno svi međusobni sudari čestica plina, popraćeni porukom brzine i energije, potpuno su elastični. To znači da nema gubitka energije ili oštrih skokova njihove kinetičke energije tijekom sudara.
- U normalnim uvjetima i konstantnoj temperaturi, prosječna energija gibanja čestica gotovo svih plinova je ista.
Možemo prepisati petu poziciju kroz ovu vrstu jednadžbe molekularno-kinetičke teorije plinova:
E=1/2mv^2=3/2kT, gdje je k Boltzmannova konstanta; T - temperatura u Kelvinima.
Ova nas jednadžba čini da razumijemo odnos između brzine elementarnih čestica plina i njihove apsolutne temperature. Sukladno tome, veći je njihov apsoluttemperatura, veća je njihova brzina i kinetička energija.
Tlak plina
Takve makroskopske komponente karakteristike, kao što je tlak plinova, također se mogu objasniti pomoću kinetičke teorije. Da biste to učinili, zamislimo sljedeći primjer.
Pretpostavimo da se molekula nekog plina nalazi u kutiji čija je duljina L. Poslužimo se odredbama gore opisane teorije plina i uzmimo u obzir činjenicu da se molekularna sfera kreće samo duž x -os. Tako ćemo moći promatrati proces elastičnog sudara s jednom od stijenki posude (kutije).
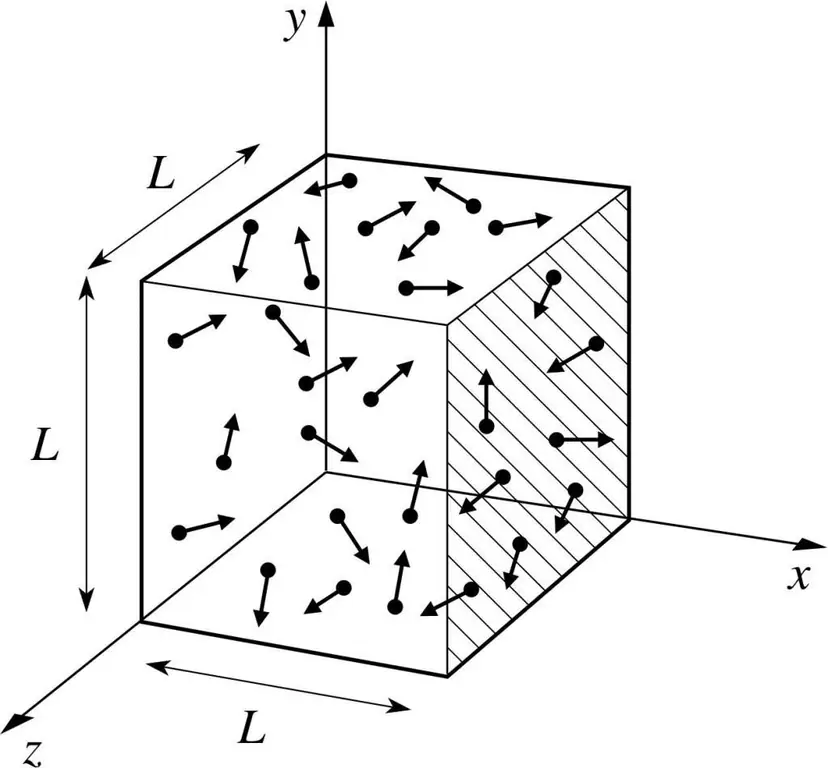
Zamah trenutnog sudara, kao što znamo, određen je formulom: p=mv, ali u ovom slučaju ova formula će poprimiti oblik projekcije: p=mv(x).
Budući da razmatramo samo dimenziju x-ose, odnosno x-osi, ukupna promjena momenta će biti izražena formulom: mv(x) - m(-v(x))=2mv(x).
Dalje, razmotrite silu koju djeluje naš objekt koristeći Newtonov drugi zakon: F=ma=P/t.
Iz ovih formula izražavamo tlak sa strane plina: P=F/a;
Sada zamijenimo izraz sile u rezultirajuću formulu i dobijemo: P=mv(x)^2/L^3.
Nakon toga, naša gotova formula tlaka može se napisati za N-ti broj molekula plina. Drugim riječima, izgledat će ovako:
P=Nmv(x)^2/V, gdje je v brzina, a V glasnoća.
Sada pokušajmo istaknuti nekoliko osnovnih odredbi o tlaku plina:
- Ona se manifestira krozsudari molekula s molekulama zidova objekta u kojem se nalazi.
- Veličina pritiska izravno je proporcionalna sili i brzini udara molekula o stijenke posude.
Neki kratki zaključci o teoriji
Prije nego što krenemo dalje i razmotrimo osnovnu jednadžbu molekularne kinetičke teorije, nudimo vam nekoliko kratkih zaključaka iz gornjih točaka i teorije:
- Mjera prosječne energije gibanja njegovih atoma i molekula je apsolutna temperatura.
- Kada su dva različita plina na istoj temperaturi, njihove molekule imaju istu prosječnu kinetičku energiju.
- Energija čestica plina izravno je proporcionalna srednjoj kvadratnoj brzini: E=1/2mv^2.
- Iako molekule plina imaju prosječnu kinetičku energiju, odnosno prosječnu brzinu, pojedine se čestice kreću različitim brzinama: neke brzo, neke sporo.
- Što je temperatura viša, to je veća brzina molekula.
- Koliko puta povećamo temperaturu plina (na primjer, dvostruko), energija gibanja njegovih čestica raste isto toliko puta (odnosno, udvostručuje se).
Osnovna jednadžba i formule

Osnovna jednadžba molekularne kinetičke teorije omogućuje vam da uspostavite odnos između količina mikrosvijeta i, sukladno tome, makroskopskih, odnosno izmjerenih količina.
Jedan od najjednostavnijih modela koje molekularna teorija može uzeti u obzir je model idealnog plina.
Moglo bi se tako rećiovo je vrsta imaginarnog modela koji proučava molekularno-kinetička teorija idealnog plina, u kojem:
- najjednostavnije čestice plina smatraju se savršeno elastičnim kuglicama koje međusobno djeluju i međusobno i s molekulama stijenki bilo koje posude u samo jednom slučaju - apsolutno elastičnom sudaru;
- privlačne sile unutar plina su odsutne, ili se zapravo mogu zanemariti;
- elementi unutarnje strukture plina mogu se uzeti kao materijalne točke, odnosno njihov volumen se također može zanemariti.
Razmatrajući takav model, njemački fizičar Rudolf Clausius napisao je formulu za tlak plina kroz odnos mikro- i makroskopskih parametara. Izgleda ovako:
p=1/3m(0)nv^2.
Kasnije će se ova formula zvati kao osnovna jednadžba molekularno-kinetičke teorije idealnog plina. Može se predstaviti u nekoliko različitih oblika. Naša je dužnost sada pokazati dijelove kao što su molekularna fizika, molekularna kinetička teorija, a time i njihove potpune jednadžbe i vrste. Stoga ima smisla razmotriti druge varijacije osnovne formule.
Znamo da se prosječna energija koja karakterizira gibanje molekula plina može pronaći pomoću formule: E=m(0)v^2/2.
U ovom slučaju možemo zamijeniti izraz m(0)v^2 u izvornoj formuli tlaka prosječnom kinetičkom energijom. Kao rezultat toga, imat ćemo priliku sastaviti osnovnu jednadžbu molekularne kinetičke teorije plinova u sljedećem obliku: p=2/3nE.
Osim toga, svi znamo da se izraz m(0)n može napisati kao umnožak dvaju količnika:
m/NN/V=m/V=ρ.
Nakon ovih manipulacija, možemo prepisati našu formulu za jednadžbu molekularno-kinetičke teorije idealnog plina u trećem, drugačijem obliku:
p=1/3ρv^2.
Pa, možda je to sve što trebate znati o ovoj temi. Ostaje samo sistematizirati stečeno znanje u obliku kratkih (i ne tako) zaključaka.
Svi opći zaključci i formule na temu "Molekularno-kinetička teorija"
Pa počnimo.
Prvo:
Fizika je temeljna znanost uključena u tečaj prirodnih znanosti, koja proučava svojstva tvari i energije, njihovu strukturu, obrasce anorganske prirode.
Uključuje sljedeće odjeljke:
- mehanika (kinematika i dinamika);
- statična;
- termodinamika;
- elektrodinamika;
- molekularni dio;
- optika;
- fizika kvanta i atomske jezgre.
Drugo:
Fizika čestica i termodinamika usko su povezane grane koje proučavaju isključivo makroskopsku komponentu ukupnog broja fizičkih sustava, odnosno sustava koji se sastoje od ogromnog broja elementarnih čestica.
Zasnovane su na molekularnoj kinetičkoj teoriji.
Treći:
Suština stvari je ovo. Teorija molekularne kinetike detaljno opisuje strukturu tvari (češće strukturu plinova nego čvrstih tvari).i tekućih tijela), na temelju tri temeljne pretpostavke koje su prikupljene iz pretpostavki istaknutih znanstvenika. Među njima: Robert Hooke, Isaac Newton, Daniel Bernoulli, Mikhail Lomonosov i mnogi drugi.
Četvrti:
Tri osnovna načela molekularne kinetičke teorije:
- Sve tvari (bez obzira jesu li tekuće, čvrste ili plinovite) imaju složenu strukturu koja se sastoji od manjih čestica: molekula i atoma.
- Sve ove jednostavne čestice su u kontinuiranom kaotičnom kretanju. Primjer: Brownovo gibanje i difuzija.
- Sve molekule pod bilo kojim uvjetima međusobno djeluju s određenim silama koje imaju električnu stijenu.
Svaka od ovih odredbi molekularne kinetičke teorije je čvrst temelj u proučavanju strukture materije.
Peti:
Nekoliko glavnih točaka molekularne teorije za plinski model:
- Svi plinovi se sastoje od elementarnih čestica koje nemaju određenu veličinu, ali imaju određenu masu. Drugim riječima, volumen ovih čestica je minimalan u usporedbi s udaljenostima između njih.
- Atomi i molekule plinova praktički nemaju potencijalnu energiju, odnosno njihova ukupna energija jednaka je kinetičkoj.
- Već smo se ranije upoznali s ovim položajem - Brownovsko gibanje. To jest, čestice plina su uvijek u kontinuiranom i nasumičnom kretanju.
- Apsolutno svi međusobni sudari atoma i molekula plinova, popraćeni porukom brzine i energije, potpuno su elastični. Ovo jeznači da nema gubitka energije ili oštrih skokova njihove kinetičke energije tijekom sudara.
- U normalnim uvjetima i konstantnoj temperaturi, prosječna kinetička energija gotovo svih plinova je ista.
Šesto:
Zaključci iz teorije o plinovima:
- Apsolutna temperatura je mjera prosječne kinetičke energije njenih atoma i molekula.
- Kada su dva različita plina na istoj temperaturi, njihove molekule imaju istu prosječnu kinetičku energiju.
- Prosječna kinetička energija čestica plina izravno je proporcionalna srednjoj kvadratnoj brzini: E=1/2mv^2.
- Iako molekule plina imaju prosječnu kinetičku energiju, odnosno prosječnu brzinu, pojedine se čestice kreću različitim brzinama: neke brzo, neke sporo.
- Što je temperatura viša, to je veća brzina molekula.
- Koliko puta povećamo temperaturu plina (na primjer, dvostruko), prosječna kinetička energija njegovih čestica također se toliko puta povećava (odnosno, udvostručuje).
- Odnos između tlaka plina na stijenke posude u kojoj se nalazi i intenziteta udara molekula na te stijenke izravno je proporcionalan: što je više udaraca, to je tlak veći, i obrnuto.
Sedmi:
Model idealnog plina je model u kojem moraju biti ispunjeni sljedeći uvjeti:
- Molekule plina mogu i smatraju se savršeno elastičnim kuglicama.
- Ove lopte mogu komunicirati jedna s drugom i sa zidovima bilo kojeposuda samo u jednom slučaju - apsolutno elastični sudar.
- One sile koje opisuju međusobni potisak između atoma i molekula plina su odsutne ili se zapravo mogu zanemariti.
- Atomi i molekule se smatraju materijalnim točkama, odnosno njihov volumen se također može zanemariti.
Osmi:
Dajmo sve osnovne jednadžbe i pokažimo formule u temi "Molekularno-kinetička teorija":
p=1/3m(0)nv^2 - osnovna jednadžba za model idealnog plina, koju je izveo njemački fizičar Rudolf Clausius.
p=2/3nE - osnovna jednadžba molekularno-kinetičke teorije idealnog plina. Izvedeno iz prosječne kinetičke energije molekula.
r=1/3ρv^2 - ista jednadžba, ali razmatrana kroz gustoću i srednju kvadratnu brzinu molekula idealnog plina.
m(0)=M/N(a) - formula za pronalaženje mase jedne molekule kroz Avogadrov broj.
v^2=(v(1)+v(2)+v(3)+…)/N - formula za pronalaženje srednje kvadratne brzine molekula, gdje je v(1), v(2), v (3) i tako dalje - brzina prve molekule, druge, treće i tako dalje do n-te molekule.
n=N/V - formula za pronalaženje koncentracije molekula, gdje je N broj molekula u volumenu plina do zadanog volumena V.
E=mv^2/2=3/2kT - formule za pronalaženje prosječne kinetičke energije molekula, gdje je v^2 srednja kvadratna brzina molekula, k je konstanta vrijednost nazvana po austrijskoj fizici Ludwiga Boltzmanna, a T je temperatura plina.
p=nkT - formula tlaka u smislu koncentracije, konstantaBoltzmanna i apsolutne temperature T. Iz nje slijedi još jedna temeljna formula, koju su otkrili ruski znanstvenik Mendeljejev i francuski fizičar-inženjer Claiperon:
pV=m/MRT, gdje je R=kN(a) univerzalna konstanta za plinove.
Prikažimo sada konstante za različite izo-procese: izobarične, izohorne, izotermne i adijabatske.
pV/T=const - izvodi se kada su masa i sastav plina konstantni.
rV=const - ako je i temperatura konstantna.
V/T=const - ako je tlak plina konstantan.
p/T=const - ako je volumen konstantan.
Možda je to sve što trebate znati o ovoj temi.
Danas smo zaronili u takvo znanstveno polje kao što je teorijska fizika, njezini višestruki dijelovi i blokovi. Detaljnije smo se dotakli takvog područja fizike kao što su temeljna molekularna fizika i termodinamika, odnosno molekularno-kinetička teorija, koja, čini se, ne predstavlja nikakve poteškoće u početnoj studiji, ali zapravo ima mnogo zamki.. Proširuje naše razumijevanje modela idealnog plina, koji smo također detaljno proučavali. Osim toga, vrijedno je napomenuti da smo se upoznali i s osnovnim jednadžbama molekularne teorije u njihovim različitim varijacijama, te razmotrili sve najnužnije formule za pronalaženje određenih nepoznatih veličina na ovu temu. Ovo će biti posebno korisno kada se pripremate za pisanje bilo kakvih testova, ispita i testova, ili za proširenje općeg pogleda i znanja o fizici.
Nadamo se da vam je ovaj članak bio koristan i da ste iz njega izvukli samo najpotrebnije informacije, ojačavajući svoje znanje o takvim stupovima termodinamike kao što su osnovne odredbe molekularne kinetičke teorije.






